Личное лекарство
Дизайнерские препараты, созданные под конкретного пациента, становятся трендом.
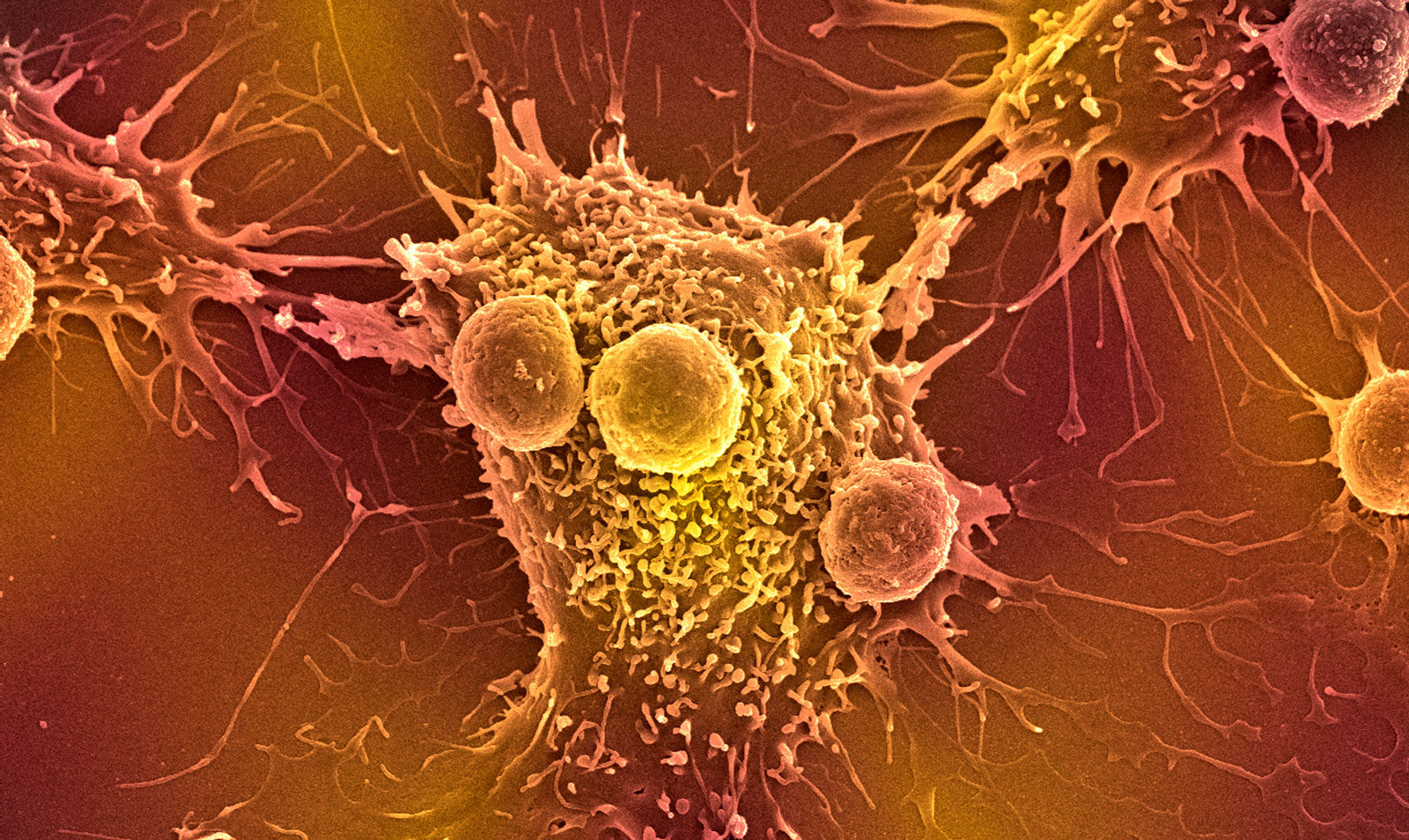
Успехи генной инженерии дают шанс вылечить считавшиеся неизлечимыми врожденные болезни и даже победить рак. По сути, фарминдустрия прямо сейчас переживает революцию: переход от массового производства препаратов к «индивидуальному пошиву» — созданию лекарств под конкретного человека. Первая генная терапия была одобрена европейскими регуляторами в 2012 году (в Китае — в 2003-м), сейчас разработки в этой области ведут многие компании. Но все имеет свою цену. Новейшие генные препараты пока стоят сотни тысяч долларов.
Генная терапия
Гены — основа жизни, они кодируют белки и определяют функционирование клеток и всего организма. В человеческом организме около 20 000-25 000 активных генов. Мутации некоторых из них приводят к гибели зародыша, другие позволяют эмбриону выжить, но нарушают нормальную работу организма. Известно около 10 000 болезней, связанных с мутацией всего лишь одного гена. Теоретически, все их можно будет лечить при помощи генной терапии.
В генотерапевтических лекарственных препаратах фармацевтическая субстанция является рекомбинантной (измененной) нуклеиновой кислотой или включает в себя рекомбинантную нуклеиновую кислоту, позволяющую осуществлять регулирование, репарацию, замену, добавление или удаление генетической последовательности. «В очень общем виде и перефразируя, это терапия, основанная на модификации генома клеток», — дает определение Дмитрий Мадера, руководитель лаборатории молекулярной генетики российской фармкомпании «Биокад».
«Сейчас мы пытаемся найти этот самый Грааль — поломки в работе генов, приводящие к возникновению болезни и сделать лекарства, которые будут „бить“ по ним. Но пока есть проблемы с внедрением в клиническую практику таких лекарств», — говорит врач-кардиолог, советник генерального директора Международного медицинского кластера Ярослав Ашихмин.
Стандартные лекарства не влияют на сами гены, они влияют лишь на их «продукты» – белки. Болезни, связанные с мутациями, онкологические заболевания, редкие (орфанные) детские болезни — во всех этих направлениях генная терапия может быть очень эффективной.
Например, к таким болезням относится гемофилия — нарушение свертываемости крови. Гемофилики страдают от постоянных кровотечений, потому что их организм из-за мутации не производит специальный белок, известный как фактор свертывания (есть несколько типов гемофилии, связанных с нехваткой разных белков).
Сейчас гемофилия лечится симптоматически — пациентам приходится регулярно делать себе инъекции факторов свертывания. В России свыше 9000 больных гемофилией, их снабжают препаратами за счет госпрограммы «Семь нозологий». Объем государственных расходов, по данным маркетингового агентства AlphaRM, составляет около 16 млрд рублей в год.
Современные методы генной инженерии могли бы помочь в лечении. Вирусы умеют «редактировать» человеческую ДНК, встраивая в нее кусочки своего генетического кода. Специальным образом модифицированный вирус, называемый «вектором», может отредактировать ДНК пациента, заменив в ней «бракованный» (мутантный) ген на нормальный. Один укол — и больной гемофилией сможет вернуться к нормальной жизни и будет навсегда избавлен от необходимости делать себе болезненные инъекции, а государство — от значительных расходов.
Но все не так просто. Мы должны «достучаться» до каждой клетки организма с помощью генной терапии. В ряде случаев ее нужно доставить именно в больные клетки, не повредив здоровые. Одна обсуждаемых в научной среде идей — использовать для доставки генов уже упомянутые векторы. Но это сопряжено с опасностью того, что помимо лекарства они принесут в клетки и «вирусную» генетическую информацию. «Поиск правильных векторов доставки — вопрос времени, работа над этим ведется во всем мире. По моим прогнозам, через 10-15 лет мы увидим рассвет генной терапии, мы сможем улучшить ситуацию с онкологическими заболеваниями, например, с помощью сплава генной терапии и иммунной терапии», — считает Ашихмин.
Иммунитет против рака
Главная особенность онкозаболеваний, которая делает их такими опасными, состоит в том, что защитная система организма — иммунитет — не опознает раковые клетки как «чужие» и не борется с ними.
Идея обучить иммунитет уничтожению опухолей кристаллизовалась еще в середине 1980-х годов. Первым шагом в этом направлении стали моноклональные антитела (MAB) – специальные белки, произведенные генетически модифицированными иммунными клетками мышей. Они нацелены на борьбу с определенной опухолью. А чтобы их не уничтожала иммунная система человеческого организма, их еще раз генетически модифицируют – «гуманизируют».
Одним из первых таких препаратов стал трастузумаб — моноклональное антитело против рака молочной железы, благодаря которому драматически вырос процент излеченных пациенток. Следующим шагом стали моноклональные антитела — блокаторы белка PD1. Этот белок умеет «выключать» иммунный ответ организма на опухоль. Блокаторы PD1 «запирают» выключатель и позволяют иммунитету расправиться с онкологией. В 2018 году за открытие блокаторов PD-1 Джеймс Эллисон из США и Тасуку Хондзе из Японии получили Нобелевскую премию. Первые блокаторы PD1 — препараты Опдиво (ниволумаб) от Bristol-Myers Squibb (BMS) и Китруда (пембролизумаб) от MSD — были зарегистрированы в США в 2014 году.
В начале 2016 года бывший тогда президентом США Барак Обама объявил «крестовый поход» против рака. Программу стоимостью $1 млрд возглавил на тот момент вице-президент США Джо Байден, у которого с онкологией личные счеты: годом ранее от рака мозга умер его 46-летний сын Бо. По сложности этот проект сравнили с запуском человека на Луну. «Давайте сделаем США страной, которая победит рак раз и навсегда», — заявил Обама. Центральную роль в этой миссии он отвел иммуноонкологическим препаратам.
Иммунная терапия сомкнулась с генной в технологии химерного антигенного рецептора CAR-T. Собственные иммунные клетки пациента — Т-лимфоциты — извлекают из его крови, с помощью генной инженерии «обучают» убивать конкретную опухоль и вводят обратно в кровоток. Преимущество этого метода состоит в том, что собственные Т-лимфоциты не отторгаются организмом, как мышиные антитела, они могут жить в нем и даже размножаться, усиливая атаку на раковые клетки.
В 2017 году американский регулятор FDA одобрил к применению две первых терапии на базе технологии CAR-T — Kymriah от Novartis и Yescarta от Gilead. Но какой ценой?
Цена здоровья
Когда в 2014 году американская компания Gilead вывела на рынок свой новый препарат от гепатита С Совальди (софосбувир) по цене $1000 за таблетку или $84 000 за стандартный 12-недельный курс лечения многие упрекнули ее в жажде наживы. Впрочем, первые генетические онкопрепараты стоят еще дороже.
При регистрации было объявлено, что Kymriah обойдется пациенту в $475 000, а Yescarta – в $373 000. Первая одобренная в США генная терапия с использованием генетически модифицированного вируса стоит еще дороже. Процедура Luxturna для лечения редкого наследственного заболевания сетчатки – амавроза Лебера – в момент регистрации в начале 2018 года была заявлена разработчиками из Spark Therapeutics по цене $850 000.
Но и это, как оказалось, не предел. В конце ноября 2018 года компания Novartis обнародовала предполагаемую свою цену за новейший генетический препарат от спинальной мышечной атрофии (СМА). Это врожденное заболевание, поражающее двигательные нейроны спинного мозга. В результате у больного отказывают мышцы, ребенок с СМА в 50% случаев погибает в возрасте до двух лет. Более мягкие формы болезни могут проявляться во взрослом и пожилом возрасте. С СМА рождается один из 6000-10 000 детей. Лечения до сих пор не существовало.
Novartis в 2018 году купила биотехнологическую компанию AveXis, одна из ее разработок — генная терапия СМА. Генетически модифицированный вирус может проникать в клетки больного и заменять дефектный ген на нормальный. В компании заявили, что считают справедливой стоимость лечения одного человека в размере $4-5 млн, аргументируя цену тем, что единственный существующий препарат от СМА Spinraza стоит $750 000 в первый год применения и $350 000 в последующие годы. Он не лечит саму болезнь, а лишь облегчает симптомы, при этом принимать его нужно всю жизнь. Если взять 10-летний период, цена в $4-5 млн не кажется чрезмерной, полагают в Novartis.
Менеджеры страховых компаний протестуют против такой высокой стоимости лечения. Но риск не только в этом — даже самый современный препарат при высокой цене может просто не найти спроса, как показывает пример первого в мире генного препарата Glybera от дефицита липопротеинлипазы. Препарат был зарегистрирован в Европе в 2012 году датской компанией UniQure. Он предназначен для исправления редкой мутации, при которой не работает фермент, расщепляющий жиры, в результате чего сосуды буквально забиваются, как трубы, жировыми сгустками. Заболевание очень редкое (1-2 случая на миллион человек) и учитывая высокую цену терапии — около $1 млн — за 5 лет оплатить лечение согласился всего один пациент. В итоге в 2017 году UniQure приняла решение не продлевать регистрацию препарата.
В России собственных разработок генных препаратов на рынке пока нет. Ближе всех к выходу на рынок блокатор PD-1 под названием BCD-100, его разрабатывает «Биокад». Препарат от рака кожи меланомы находится на финальной третьей стадии клинических исследований.
О разработке онкопрепаратов на основе технологии CAR-T объявили две отечественных компании — все тот же «Биокад» и «Р-фарм». Ожидается, что клинические испытания биокадовского CAR-T стартуют в 2019 году (до официального одобрения с этого момента пройдет еще несколько лет). В мае 2018 года глава «Биокада» Дмитрий Морозов пообещал, что стоимость создания индивидуального клеточного иммунопрепарата CAR-T для одного пациента будет примерно вдвое ниже импортных аналогов — около 16 млн рублей.
Будущее все ближе
Несмотря на все сложности, эксперты дружно сулят генным препаратам блестящие перспективы. «Я считаю, что генная терапия станет основой в лечении и, возможно, излечении многих самых разрушительных и трудноизлечимых болезней», — заявил руководитель американского Управления по продуктам и лекарствам (FDA) Скотт Готлиб после регистрации первой в США генной терапии Luxturna.
Вслед за ожиданиями растет и финансирование. Согласно данным Американского альянса регенеративной медицины (AMR) за 9 месяцев 2018 года индустрия получила $7,8 млрд инвестиций, на 34% больше, чем за аналогичный период предыдущего года.
По данным The Journal of Gene Medicine, проводится более 2800 клинических исследований генных препаратов, сейчас этот сектор — второй по интересу исследователей после традиционных химических лекарств.
Правда, более половины этих исследований (56%) находятся в первой фазе. Это значит, что до реального массового выхода генных препаратов на рынок пройдет еще как минимум несколько лет. Но в 2019 году мы точно услышим гораздо больше новостей о генной терапии.
Роман Кутузов
Фото: Gettyimages.ru
мероприятий


